- Teste de hematologie
- Teste de biochimie
- Biochimie generală din sânge și urina
- Proteine specifice in ser si urina
- Teste biochimice din lichide de punctie
- Teste biochimice din materii fecale
- Teste biochimice pentru tulburari ereditare de metabolism
- Teste pentru nefrolitiaza
- Vitamine, oligoelemente, stres oxidativ
- Acizi grași
- Transferina carbohidrat deficitara (CDT) marker pentru alcoolism
- Markeri non-invazivi pentru afecţiunile hepatice
- Analiza chimică calculi
- Markeri endocrini
- Markeri tumorali
- Markeri virali
- Markeri cardiaci
- Markeri anemie
- Markeri ososi
- Markeri boli autoimune
- Anticorpi antispermatozoizi
- Autoanticorpi in afectiuni endocrine, cardiace, renale
- Autoanticorpi in afectiuni neurologice
- Autoanticorpi in afectiunile dermatologice
- Autoanticorpi in anemia pernicioasa
- Autoanticorpi in diabetul zaharat
- Markeri pentru afectiuni hepatice si gastrointestinale autoimune
- Markeri pentru afectiuni reumatismale si vasculite
- Markeri pentru monitorizarea evolutiei si tratamentului
- Markeri pentru sindromul antifosfolipidic
- Serologie boli infectioase
- Teste specializate de alergologie si imunologie
- Teste de biologie moleculara
- Teste de citogenetica
- Teste de microbiologie
- Toxicologie
- Citologie cervico-vaginala
- Histopatologie
- Uncategorized
Virusul hepatitei B-rezistenta la medicamente antivirale
 sânge venos
sânge venos
Informatii generale si recomandari pentru testarea rezistentei virusului hepatitei B la antivirale
Virusul hepatitei B (HBV) este prototipul familiei Hepadnaviridae; replicarea acestui virus ADN prezinta o serie de particularitati ce conduc la aparitia variantelor genomice virale, clasificate in 8 genotipuri (A-H) si multiple sub-genotipuri2;3;4.
ADN-ul viral se replica prin revers-transcriptia unui ARN intermediar; deoarece revers-transcriptaza are o capacitate scazuta de verificare – autocorectare a acuratetei procesului de transcriptie, erorile in replicarea ADN-ului apar mult mai frecvent decat in cazul altor virusuri ADN. Rata anuala de aparitie a acestor erori este estimata la 1.4-3.2 x 105 substitutii nucleotidice per site, sugerand multitudinea mutatiilor ce pot aparea in cazul pacientilor cu rate inalte de replicare virala. Astfel de pacienti infectati cronic prezinta o populatie virala heterogena care este compusa din proportii variabile din cvasi-specii de HBV, iar populatia majoritara se selecteaza sub influenta factorilor endogeni si exogeni. Astfel de factori endogeni pot fi: raspunsul imun al gazdei, capacitatea replicativa a variantei virale (capacitatea sa de a produce variante infectioase), volumul spatiului de replicare (numarul de hepatocite ce pot fi infectate de HBV). Factorii exogeni descrisi pot fi: tratamente antivirale (cu analogi nucleotidici si nucleozidici), terapii imunologice (imunoglobulina anti-hepatita B si vaccinare)3.
Genotipurile HBV au raspandire geografica variata; semnificatiile clinice sunt diferite de la un genotip la altul, cu impact major asupra evolutiei naturale a bolii si a monitorizarii eficientei tratamentelor antivirale2.
Genomul VHB
Molecula ADN a HBV are structura mixta (partial dublu catenar si partial circular), consecinta a inegalitatii lungimilor celor 2 catene: catena lunga (L, de sens negativ, 3’ – 5’) are cca 3200 nucleotide, iar catena scurta (S, de sens pozitiv, 5’ – 3’) are 1100-2600 nucleotide2. Ajuns in hepatocit, ADN-ul viral este transportat in nucleul celulei, unde este transformat in ADNccc (engl. covalently closed, circular, double-stranded DNA, cccDNA), care este un ADN dublu catenar, circular, relaxat (inchis prin legaturi covalente). Acest ADNccc este in esenta un epizom care nu se replica, ci constituie exclusiv matrita transcriptiilor virale ulterioare5. Genomul viral codifica 4 cadre deschise citirii, ORF-uri (engl. open reading frames) suprapuse (vezi fig 18.3.8.1), denumite in functie de proteinele pe care le codifica:
C – proteina „core”, a nucleocapsidei (AgHBc);
S – proteina de suprafata, AgHBs;
P – ADN polimeraza virala, “pol”, cu functie si de revers-transcriptaza, denumita si polimeraza/revers-transcriptaza;
X – proteina HBx, cu functie neelucidata (posibil implicata in dezvoltarea carcinomului hepato-celular, prin legarea de p53)2;3;5.
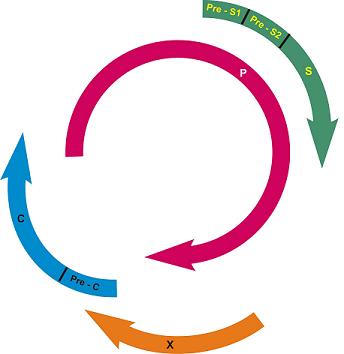 Fig 18.3.8.1. Structura genomica compacta a HBV. Aceasta structura cu gene suprapuse permite codificarea mai multor proteine. Gena S codifica proteina “majora” de suprafata, AgHBs. Regiunile Pre-S1 si pre-S2 codifica, impreuna cu S, doua proteine mai mari:
Fig 18.3.8.1. Structura genomica compacta a HBV. Aceasta structura cu gene suprapuse permite codificarea mai multor proteine. Gena S codifica proteina “majora” de suprafata, AgHBs. Regiunile Pre-S1 si pre-S2 codifica, impreuna cu S, doua proteine mai mari:
pre-S1+pre-S2+S si pre-S2+S. Cea mai mare gena – P – codifica ADN polimeraza. Gena C codifica 2 proteine nucleocapsidice: o proteina solubila, AgHBe (initiata din regiunea “pre-core”, pre-C, a genei) si o proteina „core” intracelulara, (initiata din regiunea “core”, C, a genei, aflata dupa regiunea pre-C). Gena X codifica proteinele (Ag) HBx, care pot transactiva transcriptia genelor celulare sI virale.
(Adaptare dupa Fauci AS, Kasper DL, Braunwald E et al., Harrison’s Principles of Internal Medicine, 17th Ed, http://accessmedicine.com)
Sunt definite diferite regiuni ale genomului in functie de ARN-urile virale transcrise. Astfel, regiunile „core” si „pre-core”, localizate in acelasi ORF, codifica doua ARN-uri, iar regiunea “core promoter” regleaza transcriptia acestor doua ARN-uri (vezi fig. 18.3.8.2).
Fig. 18.3.8.2: Reprezentarea schematica a regiunilor ORF-ului C al genomului HBV. De la capatul 3’ spre 5’ sunt figurate regiunile „core”, „pre-core” si „ core promoter” ale genei C.
(Adaptare dupa Watcharasak Chotiyaputta and Anna S. F. Lok, „Hepatitis B virus variants”, Nature Reviews-Gastroenterology & Hepatology. August 2009; Volume 6:453-462).
Regiunea „core” – codifica ARN pregenomic (pgRNA), care serveste atat ca matrita pentru revers-transcriptia ADN-ului viral cat si ca ARN mesager pentru doua proteine: polimeraza virala si AgHBc (vezi fig 18.3.8.3). Regiunea „pre-core” – codifica ARN mesager pre-core (precore mRNA), care serveste ca matrita pentru o proteina de mari dimensiuni care, procesata ulterior, devine AgHBe (a carei functie nu este bine precizata, dar pare a fi implicata in procesele de toleranta imunologica, contribuind la persistenta infectiei cu HBV)3.
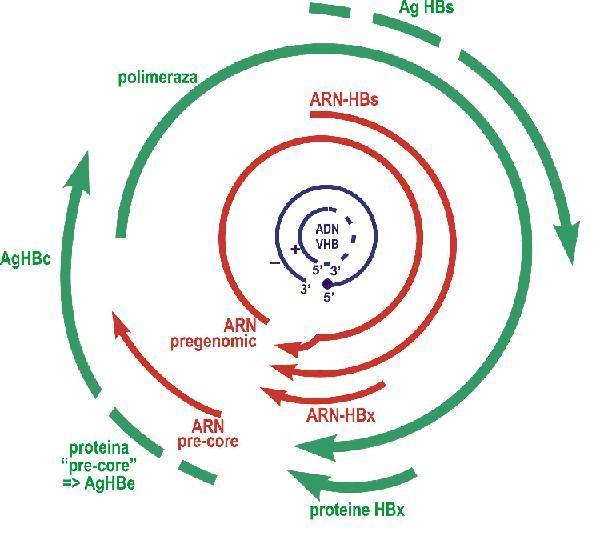
Fig. 18.3.8.3: Reprezentarea schematica a genomului HBV. ADN-ul genomic al virionului (in albastru): cercul interior, complet (3’-5’) reprezinta catena lunga; linia intrerupta indica regiunea genomica incomplet sintetizata. Sagetile verzi reprezinta ORF-urile corespunzatoare proteinelor “core”, anvelopei (AgHBs), polimerazei (“pol”) si proteinelor HBx. Liniile rosii reprezinta ARN-urile VHB5.
Semnificatiile mutatiilor genomului HBV, variantelor HBV si terapia antivirala
Dezvoltarea biologiei moleculare a condus la definirea mai multor tipuri de mutatii ale genomului VHB, in functie de localizarea lor, de mecanismul lor de aparitie si de semnificatia clinica.
Persistenta nivelelor serice detectabile de HBV la pacienti dupa seroconversia AgHBe a condus la definirea mutantelor selectate natural; esecul pe termen lung a profilaxiei cu vaccin anti-HBV si / sau cu imunoglobuline a rezultat in definirea conditiilor de aparitie a fenomenului de evaziune imunologica intermediata de AgHBe. Importanta majora o au acum cercetarile privind mutatiile induse de tratamentele cu analogi nucleozidici si nucleotidici pentru a defini cea mai buna optiune de tratament in cazul unui pacient infectat cronic cu HBV, care a primit sau nu anterior un astfel de tratament. In acest ultim caz, s-au definit si mutatiile compensatorii, care nu par a influenta direct raspunsul la tratamentul antiviral.
Variantele HBV selectate natural – mutatii la nivelul regiunilor “pre-core” si „core promoter”
Mutatiile localizate in regiunile „pre-core” si „core promoter” sunt cele mai frecvente variante de HBV cu aparitie si selectie naturala, ducand la blocarea, respectiv scaderea sintezei de AgHBe. Traditional, AgHBe era considerat marker de replicare virala si de infectiozitate cu HBV, iar seroconversia AgHBe era folosita ca indicator al incetarii replicarii virale si al remisiei bolii hepatice. Totusi, unii pacienti prezentau si dupa seroconversia AgHBe semne de afectare hepatica (nivele persistent crescute ale transaminazei ALT, continuarea procesului de inflamatie si necroza hepatica) si nivele serice detectabile de ADN HBV. Bazele moleculare ale acestei anomalii s-au dovedit a fi mutatiile la nivelul regiunilor “pre-core” si „core promoter”.
Cea mai frecventa mutatie „pre-core” este G1896A (mutatie punctiforma in nucleotida 1896). Aceasta converteste triptofanul din pozitia 28 a regiunii „pre-core” intr-un stop codon, blocand productia de AgHBe. Aceasta mutatie este intalnita cel mai frecvent la VHB genotip D, mai rar la genotipurile B, C, E. Studii longitudinale au aratat ca mutatia G1896A apare frecvent in perioada seroconversiei AgHBe. Probabil, scaderea consecutiva a productiei de AgHBe poate fi mecanismul prin care virusul se sustrage recunoasterii imune, ceea ce ar facilita chiar persistenta sa. Astfel, AgHBe poate functiona atat ca tolerogen, cat si ca imunogen, depinzand de momentul infectiei cu HBV. Aceste variante par a fi asociate cu un risc scazut de carcinom hepatocelular.
Cea mai frecventa varianta mutanta „core promoter” este de fapt o mutatie duala: A1762T si G1764A. Au mai fost descrise si alte mutatii, dar de obicei acestea sunt in asociatie cu A1762T + G1764A (in pozitiile 1753-1757, 1766, 1768). Mutatiile regiunii „core promoter” scad sinteza de ARN pre-core si, implicit, de AgHBe. Variantele de tip „core promoter” pot fi gasite la toate genotipurile HBV, cel mai adesea la genotipul C. Aceste mutatii tind sa fie selectate intr-un stadiu mai incipient al infectiei cu VHB si sa preceada seroconversia AgHBe. S-au raportat asocieri ale mutatiilor „core promoter” cu hepatita fulminanta, cu boala cronica avansata sau cu activitate inalta si, uneori, cu riscul de carcinom hepatocelular.
Studii clinice recente au aratat ca supresia virala in urma tratamentului cu analogi nucleozidici si nucleotidici este similara la pacientii AgHBe pozitivi si la cei AgHBe negativi, ceea ce indica faptul ca mutatiile pre-core si core-promoter nu influenteaza nici raspunsul si nici rezistenta la acesti agenti antivirali3.
Mutantele HBV asociate cu rezistenta la tratamentul antiviral cu analogi nucleozidici si nucleotidici – mutatii la nivelul genei P
Aceste variante mutante rezistente la tratamentul antiviral cu analogi nucleozidici si nucleotidici sunt selectate in cursul tratamentului cu astfel de analogi, deoarece mutatia insasi le confera avantaj de supravietuire fata de variantele salbatice. Analogii nucleozidici si nucleotidici au ca mecanism principal de actiune blocarea revers-transcriptiei de la nivelul ARN pregenomic cu formarea de ADN HBV.
Analogi nucleozidici inhibitori ai revers-transcriptazei (NRTIs) pot fi L-nucleozide: Lamivudina (3TC,LAM) – Zeffix, Epivir, Emtricitabine (FTC) – Emtriva, Telbivudine (LdT) – Tyzeka sau analogi de dexiguanozina: Entecavir (ETV) – Baraclude. De mentionat ca FTC nu este aprobat in Europa pentru tratamentul infectiei cronice cu HBV (doar combinatia TDF + FTC intr-o singura tableta este aprobata pentru tratamentul infectiei HIV)
Analogi nucleotidici inhibitori ai revers-transcriptazei (NtRTIs) sunt analogi nucleotidici fosfati aciclici: Adefovir (ADV) – Adefovir dipivoxil – Hepsera (analog nucleotidic difosfat) si Tenofovir (TDF) – Tenofovir disoproxil fumarate –Viread (analog nucleotidic monofosfat)4.
Mecanismul de actiune este acelasi atat pentru NRTIs, cat si pentru NtRTIs, acestia fiind preluati de catre rt–VHB si incorporati in lantul de ADN viral. Includerea acestor analogi nucleotidici/nucleozidici sintetici poate avea loc in timpul etapei de revers-transcriere a primei catene de ADN viral (catena L–), precum si in timpul sintezei celei de-a doua catene (catena S+). Acesti inhibitori competitioneaza cu dezoxiribonucleotidele naturale necesare sintezei ADN-lui viral si, din cauza absentei gruparii 3’-OH de la nivelul dezoxiribozei, nu permit urmatorului dezoxiribonucleotid inclus sa formeze urmatoarea legatura fosfat diesterica 5’–3’ necesara continuarii elongatiei lantului de ADN viral. Prin urmare sinteza ADN-lui viral este oprita, proces denumit “chain termination”.
In cazul NRTIs este necesara activarea lor intracelulara prin aditia a trei grupari fosfat la nucleul dezoxiribozei (5’), transformandu-se in NRTIs trifosfati. Aceasta etapa este realizata cu ajutorul unei kinaze celulare. NtRTIs sunt deja fosforilati si aceasta constituie avantajul lor.
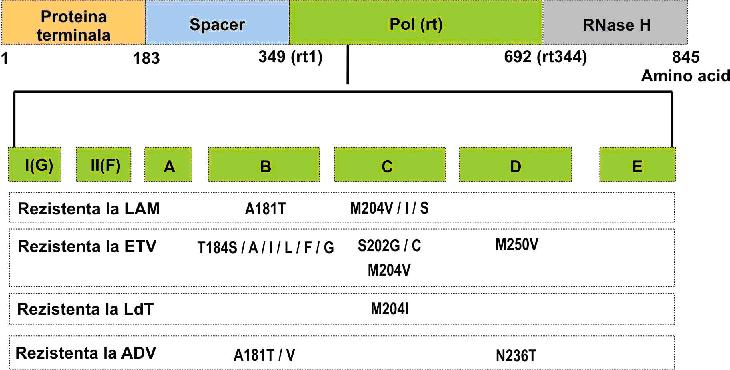
ADN-ul care codifica polimeraza HBV este un ORF caruia i se descriu 4 regiuni: o proteina terminala pentru initierea replicarii HBV, o regiune “spacer” cu rol neprecizat, o regiune cu functie de revers-transcriptaza (ADN polimeraza) denumita “Pol(rt)”, pentru replicarea virala si o regiune ribonucleazica, denumita “RNase H”, pentru degradarea ARN pregenomic. Regiunea revers-transcriptazei (rt1-rt344) este impartita in 7 domenii, de la A la G3 (vezi fig 18.3.8.4).
Fig. 18.3.8.4: Mutatiile asociate cu rezistenta la tratamentul antiviral cu analogi nucleozidici si nucleotidici sunt localizate la nivelul ORF-ului care codifica polimeraza HBV. Polimerazei VHB i se descriu 4 regiuni: proteina terminala, „spacer”, „Pol(rt)” si “RNase H”. Domeniile cu cele mai frecvente astfel de mutatii sunt B,C si D ale regiunii Pol(rt).
(Adaptare dupa Watcharasak Chotiyaputta and Anna S. F. Lok, „Hepatitis B virus variants”, Nature Reviews-Gastroenterology & Hepatology. August 2009; Volume 6:453-462).
Mutantele VHB asociate cu rezistenta la Lamivudina (LAM)
Mutatia centrala asociata cu rezistenta la LAM vizeaza zona catalitica a regiunii Pol(rt) a HBV polimerazei, mai precis secventa tirozina-metionina-aspartat-aspartat (YMDD). Aceasta mutatie implica substitutia metioninei cu valina sau cu izoleucina in pozitia 204 a secventei YMDD: rtM204V sau rtM204I. Aceasta mutatie scade susceptibilitatea (sensibilitatea) HBV pentru LAM de cca 1000 ori. Scade, de asemenea, si capacitatea virala de replicare; insa pot fi selectate adesea o serie de mutatii compensatorii (de exemplu substitutia valinei cu leucina in pozitia 173, rtV173L) care restabilesc capacitatea virala de replicare in cursul tratamentului continuu, prelungit.
Mai sunt descrise mutatiile rtM204S (in domeniul C) si rtA181T (in domeniul B)3.
Mutantele VHB asociate cu rezistenta la Entecavir (ETV)
Rezistenta la ETV apare printr-un mecanism dual: un aspect se refera la aparitia uneia dintre mutatiile rtM204V sau rtM204I (coincide cu mutatia centrala din cazul LAM) care scade susceptibilitatea (sensibilitatea) HBV pentru ETV de cca 10 ori. Al doilea aspect al mecanismului se refera la una sau mai multe mutatii localizate in pozitiile rtT184, rtS202, rtM250, caz in care susceptibilitatea (sensibilitatea) HBV pentru ETV scade de asemenea de cca 10 ori. Astfel, combinatia celor doua mecanisme conduce la o scadere a susceptibilitatii (sensibilitatii) HBV pentru ETV de peste 100 ori.
Incidenta rezistentei la ETV este scazuta la pacienti netratati anterior cu analogi nucleozidici (1% la 4-5 ani de tratament cu ETV), dar este, dimpotriva, foarte ridicata in cazurile refractare la LAM (peste 50% la 5 ani de tratament).
Mai sunt descrise mutatiile rtS202G sau rtS202C (in domeniul C) si rtT184S / A / I / L / F / G (in domeniul B) si rtM250V (in domeniul D)3.
Mutantele VHB asociate cu rezistenta la Telbivudine (LdT)
Singura mutatie demonstrata a fi asociata cu rezistenta la LdT este rtM204I. Incidenta rezistentei la LdT este mai scazuta decat in cazul LAM deoarece LdT are o activitate antivirala crescuta si pentru ca este selectata doar o singura mutatie (rtM204I, nu si rtM204V).
Incidenta rezistentei la LdT dupa 1 si dupa 2 ani de tratament este de 5% si, respectiv, 25% la pacienti AgHBe pozitivi si de 2%, respectiv, 11% la pacienti AgHBe negativi. Aceasta diferenta apare deoarece prezenta AgHBe se asociaza cu nivele crescute de ADN HBV si, implicit, risc mai mare de aparitie a rezistentei la tratament3.
Mutantele VHB asociate cu rezistenta la Adefovir (ADV)
Mutatiile asociate cu rezistenta la ADV implica substitutia alaninei cu treonina sau cu valina in pozitia 181 (rtA181T, rtA181V) si substitutia asparaginei cu treonina in pozitia 236 (rtN236T). Aceste mutatii scad susceptibilitatea (sensibilitatea) VHB pentru ADV de cca 5-10 ori.
Incidenta rezistentei la ADV s-a raportat a creste de la 0% (la 48 saptamani de tratament) pana la cca 30% la 240 saptamani, in cazul pacientilor netratati anterior cu analogi nucleozidici. Aceasta incidenta este chiar mult mai ridicata in cazurile refractare la LAM (cca 6% la 1 an si cca 25% la 2 ani de tratament) fata de doar 4% la 4 ani de tratament combinat LAM + ADV.
A fost descrisa mutatia rtI233V pentru lipsa de raspuns la ADV (dar aceasta asociatie trebuie sa fie insa confirmata)3.
Mutantele VHB asociate cu rezistenta la Tenofovir (TDF)
Pana acum nu a fost demonstrata prin studii de faza III rezistenta genotipica in cazul pacientilor care au primit tratament cu TDF timp de pana la 2 ani, mai ales pentru ca pacientii cu viremie persistenta la 72 saptamani au primit tratament aditional cu emtricitabine (FTC). Un studiu incipient, cu 2 pacienti care prezentau infectie mixta HIV + HBV, a raportat o mutatie rtA194T care ar fi implicata in rezistenta la tratamentul cu TDF, dar asociatia nu a fost confirmata3.
Relatia dintre cele mai frecvente mutatii asociate cu rezistenta la antivirale si gradul de susceptibilitate la fiecare medicat aprobat este prezentata in tabelul4 de mai jos:
|
Varianta HBV |
Grad de susceptibilitate |
||||
|
LAM |
LdT |
ETV |
ADV |
TDF |
|
|
Tip salbatic |
S |
S |
S |
S |
S |
|
M204I |
R |
R |
I |
S |
S |
|
L180M + M204V |
R |
R |
I |
S |
S |
|
A181T/V |
I |
S |
S |
R |
S |
|
N236T |
S |
S |
S |
R |
I |
|
L180M + M204V/I + I169T + V173L + M250V |
R |
R |
R |
S |
S |
|
L180M+M204V/I + T184G + S202I/G |
R |
R |
R |
S |
S |
S = susceptibil (sensibil) I = intermediar (susceptibilitate redusa) R = rezistent
Variantele anvelopei HBV – mutatii la nivelul genei S
Suprapunerea genelor VHB are implicatii clinice semnificative, mai ales in ceea ce priveste relatia reciproca dintre genele P (a polimerazei), care se suprapune complet peste gena S (care codifica AgHBs). In consecinta, mutatii aparute la nivelul genei P produc modificari la nivelul genei S si vice-versa; implicit, unele mutatii asociate cu rezistenta la tratamentul antiviral determina schimbari ale proteinei de suprafata a VHB.
Astfel, mutatia rtV173L care apare pentru a compensa scaderea capacitatii de replicare asociate cu mutatiile rtM204V sau rtM204I (vezi rezistenta la LAM) induce substitutia sE164D; mutatia rtA181T (LAM, ADV) induce aparitia unui stop codon in pozitia sTrp172X a proteinei S. Aceste schimbari scad capacitatea de legare a AgHBs de anticorpii anti- HBs si, respectiv, scad secretia de virioni.
La persoane care au primit vaccin anti-HBV si la pacienti cu transplant hepatic carora li s-a administrat ser cu imunoglobuline anti-HBV pentru a preveni recurenta infectiei VHB s-a observat selectia unei variante de HBV cu alterari ale epitopului dominant al AgHBs. Mutatia cea mai frecventa in astfel de cazuri a fost G145R, consecinta fiind alterari ale legaturii AgHBs – AcHBs si implicit evaziune imunologica.
Acelasi fenomen de evaziune imunologica datorat aceleiasi mutatii G145R a fost observata la copii care au primit vaccin anti-HBV cu sau fara imunoglobuline anti-HBV. Imunoprofilaxia a esuat desi AcHBs erau prezenti3.
In ce situatii este suspectata aparitia mutantelor rezistente la analogi nucleozidici si nucleotidici?
Aparitia rezistentei la tratamentul antiviral se manifesta initial prin cresterea viremiei serice sub tratament (“virologic breakthrough” definit in functie de nivelul de referinta al viremiei: cresterea de >1log10 peste nadir sau in mai mult de doua ocazii la distanta de o luna; sau reaparitia ADN HBV detectabil). Aceasta etapa virologica poate fi urmata de cresterea transaminazelor serice (dupa anterioara lor normalizare, “biochemical breakthrough”) si manifestari clinice de decompensare hepatica. In aceste situatii se recomanda identificarea mutatiilor care confera rezistenta la tratmentul actual si selectarea unei medicatii antivirale optime3.
Pregatire pacient – nu este necesara o pregatire speciala6.
Specimen recoltat – sange venos6.
Recipient de recoltare – vacutainer ce contine EDTA ca anticoagulant6.
Prelucrare necesara dupa recoltare – se separa plasma prin centrifugare6.
Volum proba – minim 5 mL plasmă6.
Stabilitate proba – probele de plasma sunt stabile 1 luna la -20°C6.
Metoda – reactie de polimerizare in lant (PCR) si secventiere a genelor P si S; este comunicat de asemenea genotipul HBV6.
Limite si interferente
Testarea este posibila numai in cazul existentei unei viremii B > 1000 UI/mL.
Bibliografie
1. Akarsu, Mesut; Sengonul, Aylin; Tankurt, Ethem et al, „YMDD Motif Variants in Inactive Hepatitis B Carriers Detected by Inno-Lipa HBV DR Assay”, Journal of Gastroenterology and Hepatology. 2006; Volume 21 Issue 12: 1783-8. (sursa: http://www.medscape.com/viewarticle/549393)
2. Bouchard M.J. and Schneider R.J. „The Enigmatic X Gene of Hepatitis B Virus”, Journal of Virology. 2004; Volume 78, Issue 23: 12725–12734.
3. Chotiyaputta, Watcharasak and Lok, Anna S. F. „Hepatitis B virus variants”, Nature Reviews-Gastroenterology & Hepatology. August 2009; Volume 6:453-462.
4. European Association for the Study of the Liver, „EASL Clinical Practice Guidelines: Management of chronic hepatitis B”, Journal of Hepatology. 2009; Volume 50:227-242.
5. Harrison’s Principles of Internal Medicine, 17th Edition, The McGraw-Hill Companies, United States of America, 2008.
6. Laborator Synevo. Referintele specifice tehnologiei de lucru utilizate 2015. Ref Type: Catalog.