- Teste de hematologie
- Teste de biochimie
- Biochimie generală din sânge și urina
- Proteine specifice in ser si urina
- Teste biochimice din lichide de punctie
- Teste biochimice din materii fecale
- Teste biochimice pentru tulburari ereditare de metabolism
- Teste pentru nefrolitiaza
- Vitamine, oligoelemente, stres oxidativ
- Acizi grași
- Transferina carbohidrat deficitara (CDT) marker pentru alcoolism
- Markeri non-invazivi pentru afecţiunile hepatice
- Analiza chimică calculi
- Markeri endocrini
- Markeri tumorali
- Markeri virali
- Markeri cardiaci
- Markeri anemie
- Markeri ososi
- Markeri boli autoimune
- Anticorpi antispermatozoizi
- Autoanticorpi in afectiuni endocrine, cardiace, renale
- Autoanticorpi in afectiuni neurologice
- Autoanticorpi in afectiunile dermatologice
- Autoanticorpi in anemia pernicioasa
- Autoanticorpi in diabetul zaharat
- Markeri pentru afectiuni hepatice si gastrointestinale autoimune
- Markeri pentru afectiuni reumatismale si vasculite
- Markeri pentru monitorizarea evolutiei si tratamentului
- Markeri pentru sindromul antifosfolipidic
- Serologie boli infectioase
- Teste specializate de alergologie si imunologie
- Teste de biologie moleculara
- Teste de citogenetica
- Teste de microbiologie
- Toxicologie
- Citologie cervico-vaginala
- Histopatologie
- Uncategorized
Virusul hepatitei B-genotipare
 sânge venos
sânge venos
Informaţii generale şi recomandări ale genotipării HBV
Virusul hepatitei B, un virus ADN, este membru al familiei Hepadnaviridae care se replică prin revers-transcrierea ARN-ului pregenomic încapsidat cu ajutorul polimerazei virale. Polimeraza nu prezintă capacitate de “corectare a erorilor de citire” apărute la transcriere astfel că heterogenitatea secvenţelor este o caracteristică a HBV.
Analiza secvenţelor ADN ale genomului viral a condus la identificarea a 4 gene diferite, denumite C, S, P şi X care codifică AgHBc/HBe, AgHBs, polimeraza şi respectiv proteinele HBx. Expresia acestor gene este reglată de către 4 promotori (S1p, S2p, Cp şi Xp) şi 2 intensificatori (enhancer I, II)1.
Analiza filogenetică a condus la clasificarea HBV în 9 genotipuri (denumite A-I) care diferă unul de celălalt în proporţie de >7.5% la nivelul secvenţelor nucleotidice ale întregului genom, cu mențiunea că ar mai putea exista un genotip J, care însă a fost izolat de la un singur individ. În plus, în cadrul genotipurilor A-D, F, H și I au fost descrise cel puțin 35 subgenotipuri care diferă între ele în proporţie de 4-8%2.
Cele 9 genotipuri prezintă o distribuţie geografică distinctă. Genotipul A este prevalent în nord-vestul Europei, America de Nord şi Africa, genotipurile B şi C predomină în Asia, genotipul D are o distribuţie ubicuitară, dar predomină în zona mediteraneeană. Genotipul E este întâlnit în Africa, genotipul F la populaţiile aborigene din America de Sud, iar genotipul H este limitat la populaţiile amerindiene din America Centrală. Genotipul G poate determina infecție cronică numai în prezența altor genotipuri, în special genotipul A și este transmis predominant prin contact homosexual; a fost identifcat la subiecți din USA, Mexic, Germania, Italia, Marea Britanie, Franța. Genotipul I a fost descris la persoane din Laos, Vietnam și India fiind asociat cu transmiterea perinatală. „Genotipul J” a fost izolat de la un bărbat japonez cu carcinom hepatocelular care a trăit mult timp în Borneo2.
Variația și evoluția HBV au fost influențate de recombinarea intergenotipică. Doar genotipul H nu prezintă recombinare în timp ce 97% din genotipul B este constituit din tulpini virale recombinante2.
Prima evidenţă a faptului că proprietăţile biologice ale HBV diferă în funcţie de genotip a fost observaţia că mutaţia ce introduce un codon stop prematur în poziţia 1896 a regiunii pre-core este întâlnită frecvent în regiunile în care predomină genotipul D şi este absentă în regiunile cu genotipul A. Ulterior, s-a constatat că heterogenitatea în distribuţia globală a genotipurilor HBV este responsabilă nu numai de diferenţele în prevalenţa mutaţiilor HBV în diferite populaţii, ci şi de diferenţele în evoluţia clinică a infecţiei HBV şi în răspunsul la tratamentul antiviral3.
Legătura dintre mutaţiile HBV şi genotipuri
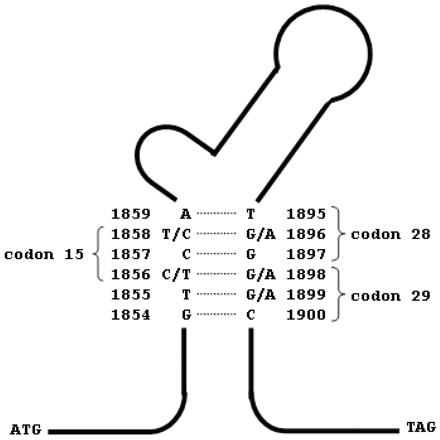
Regiunea precore-core a genomului HBV codifică proteina de fuziune precore-core care este modificată post-translaţional pentru a da naştere AgHBe. Funcţia exactă a AgHBe nu este bine cunoscută; se crede că deţine un rol în imunomodulare şi poate altera răspunsul gazdei la proteina core. Astfel, dezvoltarea mutaţiei Stop Codon 1896 G>A care împiedică exprimarea AgHBe ar reprezenta un mecanism de evaziune imună. Apariţia mutaţiei 1896 este restricţionată de către structura secundară a proteinei є asociată cu semnalul de încapsidare şi codificată de aceeaşi regiune a genomului HBV ca şi AgHBe. Destabilizarea acestei structuri prin dislocarea perechii de baze C-G între codonii 1858 şi 1896 (care ar rezulta ca urmare a mutaţiei G>A în poziţia 1896) ar fi în detrimentul replicării. Din acest motiv dezvoltarea mutaţiei 1896 depinde de prezenţa sau absenţa unei baze C sau T în poziţia 1858 şi prezintă o variaţie geografică ce poate fi corelată cu distribuţia genotipurilor (vezi figura). Genotipurile B, D şi E prezintă T1858, în timp ce genotipurile A şi H au C1858.
Genotipurile C şi F pot avea fie T1858, fie C1858 : tulpinile având genotipul F din America Centrală ca şi tulpinile având genotipul C din Japonia se caracterizează exclusiv prin T1858 , în timp ce C1858 este limitat la purtătorii genotipului C din sud-estul Asiei. În concluzie, mutaţia 1896 este întâlnită mai frecvent la pacienţii anti-HBe pozitivi infectaţi cu genotipul D şi E, rareori în asociere cu genotipul A şi doar la o minoritate din pacienţii purtători ai genotipurilor C şi F3;4.
Fig. 18.3.7.1 Structura particulară a secvenţei de încapsidare a regiunii HBV pre-core
(Adaptare după Chan HL et al. J Clin Microbiol. 2006)
Mutaţiile apărute în regiunea promotorului core (BCP = Basic Core-Promoter), transversia A>T în poziţia 1762, împreună cu tranziţia G>A în poziţia 1764 (T1762A1764) au fost descrise iniţial la pacienţi japonezi. Prezenţa acestora precede seroconversia AgHBe în cazul genotipului A, dar nu şi în cazul genotipului D; de asemenea sunt asociate cu niveluri scăzute de ARNm precore şi de expresie a AgHBe. S-a constatat o asociere semnificativă statistic a acestor mutaţii cu afectare hepatică mai severă şi vârsta >35 ani3;5. Genotipul C are o prevalență mai mare a mutațiilor BCP în comparație cu genotipul B. Conform studiilor efectuate în populația asiatică variantele BCP constituie un factor de risc independent atât pentru dezvoltarea cirozei hepatice cât și pentru carcinomul hepatocelular5.
Au fost descrise diferite mutaţii în regiunea pre-S, de la mutaţii punctiforme, deleţii şi inserţii mici până la deleţii foarte mari. În două studii independente s-a constatat că variantele cu deleţii pre-S sunt asociate mai frecvent cu genotipul B decât cu C. Dimpotrivă, un alt studiu, deşi a arătat că mutaţiile pre-S apar mai frecvent la purtătorii de genotip B şi C în comparaţie cu restul genotipurilor, nu a indicat o diferenţă semnificativă statistic între genotipurile B şi C. Aceste variante sunt detectate cu frecvenţă mai mare la pacienţii cu afecţiuni hepatice severe (ciroză sau carcinom hepatocelular), deoarece pot afecta clearance-ul viral şi contribui la cronicitatea infecţiei3.
Sunt descrise şi variante HBV care rezultă din încapsidarea şi revers-transcrierea ARN-ului pregenomic care a suferit splicing-ul – “splice variants”. Studiile au arătat că nu există nici o diferenţă între variantele dominante de splicing produse de genotipurile D, C şi E, în timp ce variantele minore de splicing sintetizate de izolatele care aparţin diverselor genotipuri sunt diferite. Splicing-ul poate contribui la patogenicitatea şi/sau persistenţa virusului3.
Legătura dintre evoluția infecției HBV şi genotipuri
În general, rata de cronicizare este mai mare în cazul infecției acute HBV cu genotipurile A/D comparativ cu genotipurile B/C5.
Pacienții infectați cu genotipurile A, B, D și F prezintă mai frecvent și mai devreme seroconversie AgHBe vs pacienții infectați cu genotipul C, independent de etnicitate. Genotipul E a fost asociat cu o rată mai mare de pozitivitate AgHBe și cu încărcături virale mai mari în comparație cu genotipul D2.
Deoarece progresia bolii este influenţată de mai mulţi factori, cum ar fi vârsta la care fost contractată infecţia, calea de transmitere, competenţa imună a gazdei şi factorii de mediu (consumul de alcool, supraîncărcarea cu fier şi expunerea la aflatoxină), interpretarea rolului exercitat de genotipuri trebuie să se facă cu multă atenţie3.
Majoritatea studiilor asupra efectului genotipurilor HBV asupra progresiei bolii au fost efectuate în sud-estul Asiei unde HBV este hiperendemic şi predomină genotipurile B şi C.
Pacienţii infectaţi cu genotipul B au o şansă mai mare de a prezenta remisiune biochimică susţinută după seroconversia AgHBe spontană decât cei infectaţi cu genotipul C. Genotipul C este mai prevalent la pacienţii cu fibroză sau ciroză şi este asociat cu o afectare histologică a ficatului mai severă în comparaţie cu genotipurile B sau D. Pacienţii infectaţi cu genotipul C au scoruri mai mari de activitate necroinflamatorie şi fibroză, precum şi niveluri mai mari ale transaminazelor serice faţă de cei infectaţi cu genotipurile B, A sau D. De asemenea, genotipul C a fost asociat cu un risc mai mare de dezvoltare a carcinomului hepatocelular comparativ cu genotipul B3.
În Occident studiile privind impactul genotipurilor HBV asupra progresiei bolii sunt mai puţin numeroase. În Europa s-a constatat că evoluţia pe termen lung a infecţiei HBV este diferită în funcţie de genotipuri. Genotipul A a fost mai prevalent la pacienţii cu hepatită cronică AgHBe pozitivă, în timp ce genotipul D a predominat la cei anti-HBe pozitivi. Pacienţii având genotipul D, fie că au fost AgHBe pozitivi sau negativi, au prezentat valori mai mari ale încărcăturii virale, în comparaţie cu genotipurile A, B şi C. Prognosticul hepatitei cronice B ar fi mai bun la pacienţii infectaţi cu genotipul A faţă de cei cu genotipul D sau F, deoarece prezintă o rată mai mare de remisiune biochimică susţinută şi de reducere a viremiei. Genotipul D a fost asociat cu o afecţiune recurentă severă post-transplant3.
România se situează în rândul ţărilor cu o prevalenţă înaltă a purtătorilor de AgHBs (16%). Într-un studiu publicat recent care a inclus 130 pacienţi, cu un spectru variat al infecţiei HBV, s-a constatat că genotipul D a avut prevalenţa cea mai mare (66%) şi a fost asociat cu infecţie activă şi evoluţie spre carcinom hepatocelular. Genotipul A a fost corelat cu statusul de purtător inactiv al AgHBs, în timp ce infecţia cronică îndelungată a fost asociată în majoritatea cazurilor cu un amestec al genotipurilor A şi D6.
Legătura dintre răspunsul la tratamentul antiviral şi genotipuri
Într-un studiu efectuat pe pacienţi germani s-a constatat că cei infectaţi cu genotipul A au o rată de seroconversie AgHBe mai mare sub tratamentul cu interferon alfa pegylat (PegINFα) decât cei cu genotipul D. Într-un studiu desfăşurat în Taiwan rata dispariţiei AgHBe sub PegINFα a fost semnificativ mai mare la pacienţii cu genotip B comparativ cu genotipul C.
În ceea ce priveşte răspunsul la lamivudină, genotipul B este asociat cu un răspuns virusologic mai bun în comparaţie cu genotipul C la pacienţii din Taiwan. Cu toate acestea, ambele genotipuri prezintă un risc similar de dezvoltare a rezistenţei la lamivudină după un an de terapie. Mutaţiile asociate cu rezistenţă la lamivudină se dezvoltă mai lent în cazul genotipului D.
Într-un studiu mare efectuat în Japonia rata de apariţie a rezistenţei la lamivudină a fost independentă de genotipurile A, B şi C. Acest studiu a sugerat de asemenea că impactul pozitivităţii AgHBe asupra rezistenţei la lamivudină diferă în funcţie de genotipuri şi că riscul dezvoltării unei hepatite severe este mai mare la pacienţii infectaţi cu genotipul C3.
Conform ghidului European Association for the Study of Liver (EASL) 2017 informațiile privind genotipurile HBV pot fi utile în stabilirea regulilor de oprire ale tratamentului cu PegINFα:
- la pacienții cu hepatită cronică AgHBe pozitivă, nivelurile AgHBs > 20000 UI/mL în cazul genotipurilor B și C sau absența reducerii nivelului AgHBs în cazul genotipurilor A și D după 12 săptămâni de tratament se asociază cu o probabilitate foarte redusă de seroconversie AgHBe și pot fi utilizate drept regulă de oprire a terapiei cu PegINFα.
- la pacienții cu hepatită cronică AgHBe pozitivă și genotip A-D, nivelurile AgHBs > 20000 UI/mL după 24 săptămâni de tratament se asociază cu o probabilitate foarte redusă de seroconversie AgHBe și pot fi utilizate drept regulă de oprire a terapiei cu PegINFα.
- la pacienții cu hepatită cronică AgHBe negativă și genotip D, absența reducerii nivelului AgHBs și o scădere < 2 log10 UI/mL a viremiei B după 12 săptămâni de tratament se asociază cu o probabilitate foarte redusă de răspuns la tratament și și pot fi utilizate drept regulă de oprire a terapiei cu PegINFα7.
Pregătire pacient – nu este necesară o pregatire specială8.
Specimen recoltat – sânge venos8.
Recipient de recoltare – vacutainer ce conţine EDTA ca anticoagulant8.
Prelucrare necesară după recoltare – se separă plasma prin centrifugare8.
Volum probă – minim 5 mL plasmă8.
Stabilitate probă – plasma separată este stabilă 1 lună la -20ºC8.
Metodă – reacţie de polimerizare în lanţ urmată de revers-hibridizare cu sonde oligonucleotidice specifice pe stripuri8.
Limite şi interferenţe
Efectuarea genotipării HBV nu este recomandată pentru screening-ul sau confirmarea infecţiei HBV. Testul este posibil numai în cazul existenţei unei viremii B > 1000 UI/mL8.
Bibliografie
- Margaret James Koziel, Chloe Lynne Thio. Hepatitis B Virus and Hepatitis D Virus. In Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases, 7th edition, Churchill Livingstone, Elsevier, 2010, 2059-2064.
- Kramvis A. Genotypes and genetic variability of hepatitis B virus. Intervirology. 2014;57(3-4):141-50.
- Kramvis A, Kew MC. Relationship of Genotypes of Hepatitis B Virus to Mutations, Disease Progression and Response to Antiviral Therapy. J Viral Hepat. 2005; 12(5): 456-64.
- Chan HL, Tse CH, Ng EY, Leung KS, Lee KH, Tsui SK, Sung JJ. Phylogenetic, virological, and clinical characteristics of genotype C hepatitis B virus with TCC at codon 15 of the precore region. J Clin Microbiol. 2006 Mar;44(3):681-7.
- Lin CL, Kao JH. Hepatitis B virus genotypes and variants. Cold Spring Harb Perspect Med. 2015 May 1;5(5):a021436.
- Constantinescu I, Nedelcu F, Toader MA. Clical and Therapeutical Importance of HBV Genotyping in Romania. J Med Life. 2008 Apr-June;1(2):165-73.
- European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection J Hepatol. 2017 Apr 18. pii: S0168-8278(17)30185-X. doi: 10.1016/j.jhep.2017.03.021. [Epub ahead of print].
- Laborator Synevo. Referinţele specifice tehnologiei de lucru utilizate. 2017. Ref Type: Catalog.