- Teste de hematologie
- Teste de biochimie
- Biochimie generală din sânge și urina
- Proteine specifice in ser si urina
- Teste biochimice din lichide de punctie
- Teste biochimice din materii fecale
- Teste biochimice pentru tulburari ereditare de metabolism
- Teste pentru nefrolitiaza
- Vitamine, oligoelemente, stres oxidativ
- Acizi grași
- Transferina carbohidrat deficitara (CDT) marker pentru alcoolism
- Markeri non-invazivi pentru afecţiunile hepatice
- Analiza chimică calculi
- Markeri endocrini
- Markeri tumorali
- Markeri virali
- Markeri cardiaci
- Markeri anemie
- Markeri ososi
- Markeri boli autoimune
- Anticorpi antispermatozoizi
- Autoanticorpi in afectiuni endocrine, cardiace, renale
- Autoanticorpi in afectiuni neurologice
- Autoanticorpi in afectiunile dermatologice
- Autoanticorpi in anemia pernicioasa
- Autoanticorpi in diabetul zaharat
- Markeri pentru afectiuni hepatice si gastrointestinale autoimune
- Markeri pentru afectiuni reumatismale si vasculite
- Markeri pentru monitorizarea evolutiei si tratamentului
- Markeri pentru sindromul antifosfolipidic
- Serologie boli infectioase
- Teste specializate de alergologie si imunologie
- Teste de biologie moleculara
- Teste de citogenetica
- Teste de microbiologie
- Toxicologie
- Citologie cervico-vaginala
- Histopatologie
- Uncategorized
Citologie cervico-vaginală Babeș–Papanicolaou în mediu lichid
Sinonime: PAP test, citologie cervico-vaginală Babeş-Papanicolaou, frotiul cervico-vaginal
Informaţii generale şi recomandări
Cancerul colului uterin este o problemă de sănătate publică în întreaga lume, afectând cu precădere femei între 35-50 ani aflate în perioada activă socială şi profesională. Dintre ţările Uniunii Europene, România prezintă una dintre cele mai ridicate rate a mortalitaţii prin cancer de col uterin, principalul tip de cancer genital şi a doua cauză de deces prin cancer la femeile din ţara noastră6. Depistarea leziunilor colului uterin într-o etapă timpurie a carcinogenezei şi abordarea integrată a informaţiilor clinice şi citologice, cu modularea conduitei diagnostice şi terapeutice conform unor protocoale larg acceptate reprezintă cheia în scăderea incidenţei leziunilor de grad înalt şi a cancerului invaziv. În ţările în care se desfăşoară programe de screening, acestea şi-au dovedit eficienţa, incidenţa cancerului de col uterin scăzând foarte mult.
HPV (human papilloma virus) este considerat cauza majoră a cancerului de col uterin. Transformarea celulelor agresate viral în celule displazice şi apoi în celule canceroase necesită însă şi existenţa altor factori. Infecţia cu HPV care este considerată o boală cu transmitere sexuală, apare mai frecvent în legătură cu: debutul precoce al vieţii sexuale, promiscuitate, parteneri multipli, fumat. Există categorii cu risc de a dezvolta o leziune displazică şi chiar cancer invaziv în urma infecţiei HPV, respectiv paciente cu nivel scăzut al imunităţii care nu pot elimina virusul sau localiza leziunile determinate de acesta. În acelaşi timp este important şi genotipul viral, deoarece există peste 100 tulpini de HPV, dintre care aproximativ 40 au tropism pentru tractul genital inferior.
Pe criterii epidemiologice acestea au fost clasificate în: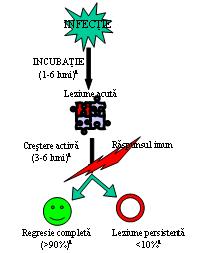
– cu risc scăzut (low-risk): 6, 11, 40, 42, 43, 44, 54, 61, 70, 81 şi CP6108, care rareori determină leziuni care progresează spre leziuni de grad înalt şi cancer;
– probabil cu risc crescut: 26, 53, 66;

– cu risc crescut (high-risk): 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 , 68, 73 şi 82.1
Fig. 22.1: Istoria naturală a infecţiei HPV: în urma infecţiei cu HPV apare o leziune acută, care în funcţie de intervenţia răspunsului imun al gazdei poate regresa sau poate da o leziune persistentă.
Cea mai eficientă şi larg utilizată metodă, folosită în multe ţări în cadrul programelor de screening pentru cancerul colului uterin, care se poate realiza relativ cu uşurinţă asupra unei populaţii largi, este reprezentată de citologia cervico-vaginală,.
În general, Pap testul se recomandă a fi efectuat periodic la intervale de 3 ani între 21 şi 65 ani sau la 3 ani de la începutul vieţii sexuale, deoarece se consideră că majoritatea infecţiilor cu HPV sunt contactate in primii ani de la debutul vieţii sexuale (18-25 ani)8.
Citologia cervico-vaginală care se realizează în laboratorul Synevo beneficiază de avantajele tehnologiilor de vârf din acest domeniu: recoltare în mediu lichid, îmbogăţirea masei celulare cu eliminarea detrisurilor şi a altor elemente ce pot interfera cu rezultatul, colorare automată, analiză computerizată.
Citologia in mediu lichid (LBC) ajută la scăderea semnificativă a cazurilor nesatisfăcătoare faţa de testele convenţionale, reducând astfel nevoia repetării nejustificate a prelevării.
Prin recoltarea in mediu lichid, întreaga probă recoltată este trimisă la laborator pentru procesare, fără pierderea sau deteriorarea celulelor recoltate.
Procesul de prelucrare realizează separarea, reducerea detritusurilor (sânge, mucus) şi a celulelor inflamatorii, cu conservarea caracteristicilor necesare pentru interpretare, permiţând o vizualizare mai rapidă şi mai calitativă a celulelor relevante clinic.
Procesarea şi colorarea lamelor se realizează în sistem automat pentru asigurarea unei calităţi ridicate şi a unor rezultate standardizate.
Sistemul de analiză computerizată scanează toate frotiurile în mediu lichid sau convenţionale şi ajută la îmbunătăţirea calităţii interpretării lor prin direcţionarea atenţiei patologului asupra câmpurilor microscopice care cel mai probabil conţin anomalii, prin clasificarea frotiurilor conform unui sistem de cuantificare a riscului bazat pe măsurarea a sute de parametri celulari.
Prin acest sistem se realizează o detecţie crescută a cazurilor HSIL-pozitive atât pe LBC cât si pe preparatul convenţional, precum şi îmbunataţirea detecţiei LSIL pe cele convenţionale.
Sistemul poate reduce semnificativ timpul de examinare şi, implicit, timpul în care este elaborat diagnosticul final, fără a scădea rata de detecţie a leziunilor importante clinic.
Pregătire pacientă – cu 24-48 ore înainte de recoltarea probei trebuie să fie evitate: raporturile sexuale, lavajul vaginal, alte tratamente intravaginale (geluri, creme, contraceptive, dezinfectante, lubrifianţi) sau alte manevre intravaginale (tampoane intravaginale, explorare vaginală).
-Se recomandată recoltarea în afara perioadei menstruale, în perioada de mijloc a ciclului menstrual, iar în cazul infecţiilor, după tratarea acestora.
-În cazul procedurilor medico-chirurgicale, se recomandă recoltarea înainte de examinarea manuală, înainte sau la minim 24 ore postcolposcopie cu aplicaţie de acid acetic, la 3 luni de la recoltări anterioare, iar în cazul electrorezecţiilor, polipectomiilor ca şi postpartum ar trebui să existe un interval de 1.5-3 luni4;7.105
Specimen recoltat – celule ale zonei exocervicale, endocervicale şi de tranziţie dintre acestea (zona de transformare). Zona de transformare reprezintă sediul cel mai frecvent al leziunilor preneoplazice (turn-over crescut, expusă microtraumatismelor, sensibilitate crescută la acţiunea HPV), acolo unde epiteliul scuamos al exocolului se continuă cu cel de tip glandular de la nivel endocervical prin intermediul unei zone de metaplazie scuamoasă.
Recoltare – se efectuează cu ajutorul periuţei cervicale cu cap detaşabil. Pentru recoltarea în mediu lichid sunt recomandate dispozitivele din plastic. După recoltare, partea detaşabilă a instrumentului este introdusă în flaconul cu mediu lichid, fără a se efectua alte manevre asupra suprafeţei care conţine materialul celular.
Fig.22.2: Periuţa Cervex-Brush10 Fig. 22.3: Flacon fixare şi transport10
Instrucţiuni de recoltare – După vizualizarea colului uterin se inseră partea centrală a periuţei în canalul endocervical astfel încât marginile mai scurte să vină în contact cu exocervixul. De obicei nu se recomandă ştergerea colului uterin înainte de recoltare, dar la nevoie se poate tampona uşor cu un tifon7. Cu partea centrală fixă, se roteşte complet periuţa în sensul acelor de ceasornic de cinci ori 5.
Proba astfel recoltată trebuie imediat fixată pentru a se evita deteriorarea probei. În acest scop se detaşează capătul periuţei care conţine materialul recoltat şi se introduce în recipientul cu mediu lichid.
Fig.22.4: Detaşare capăt recoltare10
Se acoperă flaconul cu capacul, se înşurubează pentru a nu se varsa lichidul, se etichetează imediat (sau înaintea recoltării probei) şi se transportă la laborator împreună cu fişa de însoţire a pacientei în vederea prelucrării.
! După recoltarea cu periuţa nu este necesară efectuarea altor manevre (de descărcare) asupra capătului de recoltare. La laborator este trimis flaconul în care se găsesc: lichidul fixator şi capătul detaşabil al periuţei.
Este foarte important ca, pe lângă corectitudinea recoltării, proba să fie însoţită şi de datele clinice cât mai complete ale pacientei: vârsta, data ultimei menstruaţii, data recoltării, antecedente medicale, tratamente, metode de contracepţie, rezultate anterioare ale Pap testului etc3;8.
Stabilitate probă – termenul de păstrare a mediului lichid fără proba recoltată este de 36 luni de la data fabricaţiei la temperatura camerei (15-30°C). După recoltare, proba cu materialul celular se poate păstra 6 luni la 2-10°C sau 4 săptămâni la temperatura camerei (15-30°C)5.
Metodă – citologie în mediu lichid, coloraţie Papanicolaou. Prelucrarea şi colorarea LBC se realizează în mod automat. Lamele sunt scanate şi analizate prin sistemul computerizat care asistă medicul în elaborarea rezultatului.
Avantajele LBC:
– recoltare facilă şi rapidă, fără riscul distrugerii sau deteriorării celulelor;
– 100% din celulele epiteliale diagnostice recoltate sunt transferate la laborator;
– fixare mai eficientă în mediul de transport;
– înlăturarea majorităţii factorilor de obscurare şi realizarea unui frotiu alcătuit dintr-un singur strat de celule uniform distribuit, concentrat într-o zonă mică, facilitând interpretarea şi îndeplinirea condiţiilor de acceptabilitate;
– scăderea numărului de probe ce trebuie repetate în urma raportării ca fiind nesatisfăcătoare;
– compatibil cu sistemul automat de îmbogăţire celulară, colorare şi interpretare asistată de calculator.
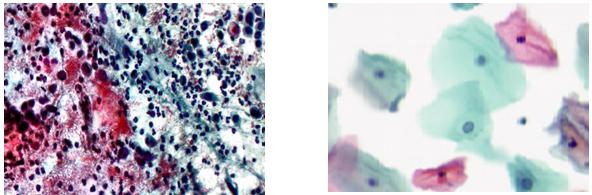
Fig.22.5: Frotiu convenţional Fig.22.6: LBC
Limite şi interferenţe:
– factori care ţin de calitatea tehnică: nerespectarea condiţiilor privitoare la pregătirea pacientelor sau la momentul recoltării. Ex: recoltare în perioada menstruală, folosire de lubrifiante intravaginale înaintea/în timpul recoltării etc.
– factori fiziologici sau patologici care ţin de paciente: sarcină, lehuzie, postpartum (interval de 6-8 săptămâni), atrofie (se poate recomanda terapie trofică locală cu estrogeni), radioterapie.
– celularitatea scăzută a frotiului poate limita posibilitatea elaborării unui diagnostic (criteriul acceptabilităţii). Totuşi, preparatele se vor examina pentru a determina cauzele probabile ale acestei deficienţe, care în anumite condiţii poate fi normală, sau pentru prezenţa celulelor atipice, caz în care se precizează în buletinul de analiză că preparatul are celularitate la limită sau scăzută. LBC şi sistemul de „imbogaţire celulară” ajută la îndeplinirea acestui criteriu, dar există un minim necesar de 5000 de celule3.
– absenţa celulelor endocervicale sau metaplaziate semnifică eşantionarea inadecvată a zonei endocervicale, iar aceasta se specifică în buletinul de raportare.
– factorii de obscurare pot interfera cu interpretarea atunci cand afectează >75% (nesatisfăcător) sau 50-75% dintre celule (satisfăcător, dar parţial obscurat). Cea mai mare parte a acestor inconveniente sunt înlăturate prin recoltarea în mediu lichid3.
– calitatea celulelor importante pentru diagnostic poate fi influenţată de manevre medico-chirurgicale locale practicate anterior recoltării: examinare manuală, aplicaţie lugol/acid acetic, recoltări anterioare, electrorezecţii etc.
– Pap testul reprezintă un instrument foarte util de screening folosit în depistarea precoce sau în stadii incipiente ale cancerului cervical, dar trebuie urmat întotdeauna de alte investigaţii înainte de a se lua o decizie terapeutică. Pap testul triază eficient pacientele care vor efectua investigaţii suplimentare (colposcopie) în vederea stabilirii de către medicul clinician a atitudinii terapeutice.
Cauze de respingere a probei
– probă necorespunzătoare: flacon deteriorat, mediu de transport absent/insuficient, absenţa din flacon a capătului de recoltare al periuţei;
– probă neetichetată, fişă incompletă fără datele clinice şi de identificare complete ale pacientei.
Rezultate, elaborarea diagnosticului
În urma prelucrării şi examinării probei, rezultatul se elaborează conform Sistemului de raportare a citologiei colului uterin Bethesda 20013.
Termeni utilizaţi:
– acceptabilitatea specimenului;
– modificări non-neoplazice – NILM;
– anomalii ale celulelor epiteliale scuamoase: ASC-US, ASC-H, LSIL, HSIL, SCC;
– anomalii ale celulelor glandulare-AGC, AIS, adenocarcinom.
1. Acceptabilitatea specimenului: criteriile necesare a fi îndeplinite de un preparat pentru a fi raportat ca fiind satisfacător pentru interpretare sunt:
- de celularitate minimă: chiar dacă metoda LBC înlătură cea mai mare parte dintre inconvenientele frotiurilor convenţonale, asigurând ajungerea în laborator a 100% din materialul recoltat şi selectarea masei celulare importante pentru diagnostic, există un minim necesar de celule scuamoase bine conservate şi uşor de vizualizat pentru elaborarea diagnosticului (5000)3;
- prezenţa celulelor endocervicale sau din zona de transformare: indică recoltarea corespunzătoare a frotiului cu eşantionarea zonei de transformare (minim 10 celule endocervicale sau metaplaziate bine conservate, izolate sau grupate). Precizarea prezenţei/ absenţei celulelor endocervicale/metaplaziate nu este necesară în leziunile de grad înalt sau invazive3;
- factori de obscurare: sânge, mucus etc. Se consideră că un frotiu este nesatisfăcător atunci când >75% dintre celulele scuamoase sunt acoperite şi parţial obscurat dar satisfăcător pentru interpretare dacă 50-75 % dintre celule sunt obscurate, cu condiţia ca pe frotiu să nu fi fost identificate celule atipice. LBC are avantajul că înlătură cei mai mulţi dintre aceşti factori3;
*ASCCP 2007 recomandă în caz de teste nesatisfăcătoare repetarea la 2-4 luni, repetare la 12 luni pentru cele cărora le lipseşte componenta endocervicală sau parţial obscurate7.
2. NILM – frotiu negativ pentru leziuni intraepiteliale sau maligne
- microorganisme: paraziţi (Trichomonas vaginalis), organisme fungice compatibile cu Candida, modificări ale florei vaginale compatibile cu diagnosticul de vaginoză, bacterii sugestive pentru genul Actinomyces, modificări celulare sugestive pentru infecţia cu Virus Herpes Simplex (HSV);
- alte modificări non-neoplazice: modificări celulare reactive asociate cu: inflamaţia, iradierea, dispozitive contraceptive intrauterine; prezenţa de celule glandulare (status posthisterectomie), atrofie.
3. Altele – celule endometriale la femei >40 ani
4. Anomalii ale celulelor epiteliale:
Scuamoase:
-
Celule scuamoase atipice: – cu semnificaţie nedeterminată (ASC-US)– nu se poate exclude HSIL (ASC-H)
- Leziuni scuamoase intraepiteliale de grad scăzut (LSIL) – includ modificări induse de HPV; displazia uşoară; CIN1
- Leziuni scuamoase intraepiteliale de grad înalt (HSIL) – includ leziunile: CIN2 (displazia moderată) şi CIN3 ( displazia severă şi carcinomul in situ)
- Carcinom cu celule scuamoase
Glandulare:
- Celule glandulare atipice (endocervicale, endometriale, glandulare) cu semnificaţie neprecizată (AGC-NOS).
- Celule glandulare atipice (endocervicale, glandulare) sugestive pentru neoplazie (FN).
- Adenocarcinom endocervical in situ (AIS).
- Adenocarcinom endocervical, endometrial, extrauterin, cu semnificaţie neprecizată (NOS).
5. Alte leziuni maligne
Interpretarea rezultatelor, recomandări
Rezultatul Pap testului trebuie interpretat prin corelarea cu datele clinice ale pacientelor precum şi cu alte investigaţii efectuate. Astfel, în funcţie de suspiciunea ridicată în urma Pap testului, prin integrarea în contextul clinic de către medicul curant, se pot formula recomandările privitoare la conduita terapeutică şi diagnostică ce trebuie urmată. Asociaţiile profesionale medicale din domeniu au elaborat o serie de recomandări asupra atitudinii de urmat în funcţie de rezultatele Pap testului1;2;6.
- NILM – semnifică absenţa leziunilor intraepiteliale sau a malignităţii. Această categorie este folosită şi pentru a raporta prezenţa colonizării cu microorganisme, dar şi a leziunilor reactive sau reparatorii ale celulelor ca răspuns la infecţii, iradiere, DIU etc. Raportarea celulelor glandulare benigne posthisterectomie poate semnifica: adenoză, prolaps salpingian, metaplazie etc. Tot în categoria NILM sunt incluse şi modificările induse de atrofie.
- Celulele endometriale la femei cu vârste peste 40 ani – pot sugera riscul unei patologii endometriale care pentru femeile în premenopauza este mic (în general patologie benignă: polipi, hiperplazie simplă), în timp ce la femeile în postmenopauză ele pot indica necesitatea investigării endometrului prin corelarea cu semnele şi simptomele clinice, terapii hormonale etc. Prezenţa celulelor endometriale este normală pe specimenele menstruale sau din timpul fazei proliferative a ciclului menstrual.
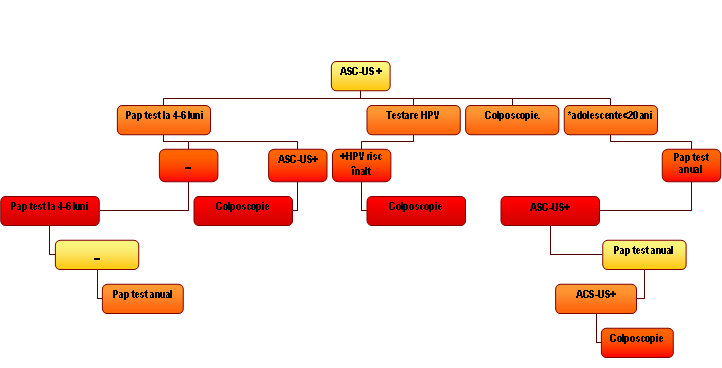
- Celule scuamoase atipice:
ASC-US: – semnifică prezenţa de celule epiteliale atipice a căror semnificaţie nu poate fi precizată. Modificările celulelor epiteliale sunt mai importante decât cele din procesele inflamatorii, dar nu suficiente pentru interpretarea ca leziune intraepitelială.
– prezintă un risc pentru o leziune de grad înalt de 10-20%9.
– în general există trei recomandări: 1. repetare la 4-6 luni
2. testare HPV – cu risc înalt
3. colposcopie
* La adolescente (<20 ani) se repetă citologia anual timp de doi ani, iar în cazul unor rezultate pozitive repetate pentru ASC-US, se recurge la colposcopie cu biopsie
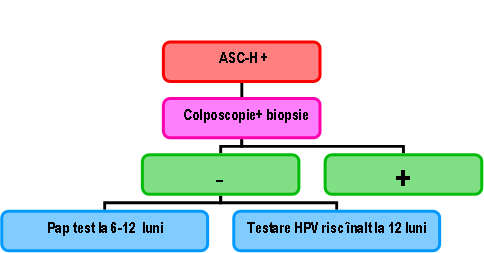
ASC-H: – sugerează prezenţa unor celule epiteliale atipice sugestive pentru leziuni intraepiteliale de grad înalt, dar care nu întrunesc pe deplin criteriile cantitative sau calitative pentru calificarea ca HSIL.
– 50% din citologiile cu ASC-H ascund riscul unei leziuni de grad inalt9;
– din aceste motive, ghidurile internaţionale recomandă efectuarea colposcopiei cu biopsia ariilor suspecte2,6.
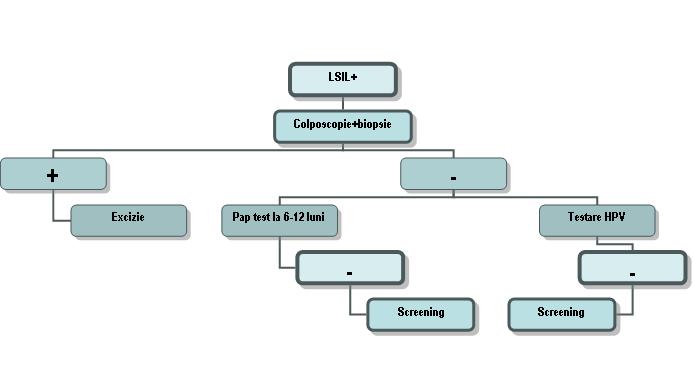
LSIL: – sugerează modificări ale celulelor epiteliale scuamoase compatibile cu o leziune intraepitelială de grad scăzut. Termenul de leziune intraepitelială se referă la faptul că modificările celulare sunt strict localizate la nivelul epiteliului de acoperire al colului uterin, fără a depăşi membrana bazală, deci fără potenţial invaziv. Într-o leziune de grad scăzut modificările atipice sunt prezente doar la unele dintre celulele scuamoase.
– în această categorie sunt încadrate modificările celulare induse de HPV şi CIN1 (displazia uşoară);
– reprezintă indicaţie pentru colposcopie cu biopsia leziunilor suspecte.
*femei în postmenopauză: unele paciente pot prezenta celule atipice (atipie de menopauză) care nu necesită tratament.
**adolescente (<20 ani): este preferată urmărirea clinică prin repetare la 12 luni a citologiei timp de 2 ani. Atitudinea de expectativă este justificată de faptul că la adolescente, datorită sistemului imun competent, majoritatea leziunilor dispar de la sine, faţă de o rată de regresie spontană mai scăzută la femeile adulte.
***femei însărcinate: colposcopie înainte (pentru excluderea unei leziuni invazive) şi după naştere.
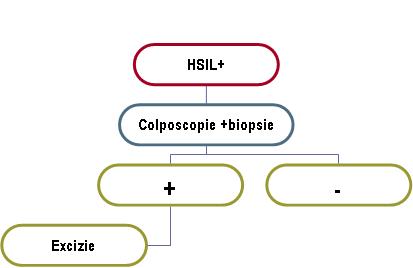
HSIL: – sugerează prezenţa unei leziuni intraepiteliale de grad înalt în care atipiile celulare sunt mai mari şi afectează o proporţie mai mare din celulele epiteliale, dar sunt încă limitate la epiteliul de acoperire al colului uterin fără a depăşi membrana bazală.
– apare ca urmare a persistenţei şi evoluţiei unei leziuni de etiologie HPV.
– include modificări CIN2 (displazia moderată) şi CIN3 (displazia severă şi CIS).
– conform recomandărilor, necesită confirmare imediată prin colposcopie şi biopsie.
*la femeile însărcinate, colposcopia poate exclude o leziune invazivă.
**la adolescente este recomandată colposcopia şi biopsia zonelor suspecte. În caz de biopsie pozitivă cu displazie moderată, atitudinea recomandată este de urmărire colposcopică şi prin citologie la 6 luni timp de 2 ani, cu repetarea biopsiei dacă leziunea persistă, caz în care este indicată electrorezecţia. În caz de displazie severă pe biopsie se impune excizia leziunii.
SCC: – indică prezenţa unei leziuni neoplazice invazive care a depăşit stadiul de leziune intraepitelială prin extensia dincolo de membrana bazală.
- CELULE GLANDULARE ATIPICE:
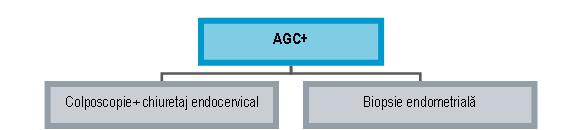
AGC: – această categorie reuneşte modificările atipice ale celulelor epiteliului glandular superioare celor din leziunile reactive sau reparatorii dar insuficiente pentru neoplazie
– dacă este posibilă identificarea originii, atunci se precizează în raport, în caz contrar sunt încadrate în categoria NOS
– dacă modificările celulare sunt sugestive pentru prezenţa unei leziuni neoplazice, se precizează în raport ca fiind sugestive pentru neoplazie. Specificaţia NOS este folosită atunci când nu este posibilă precizarea potenţialului neoplazic al celulelor glandulare atipice
– se recomandă colposcopie cu biopsia ariilor suspecte şi chiuretaj endocervical în cazul celulelor glandulare atipice cu origine endocervicală sau biopsie endometrială pentru cele endometriale
* la femeile >35-40 ani sau <35 ani cu sângerări anormale este indicată investigarea endometrului
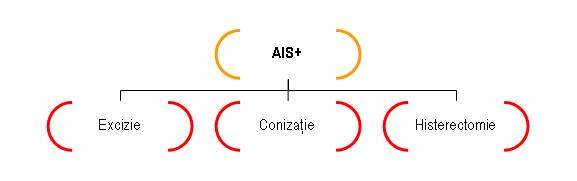
AIS: – semnifică prezenţa unei leziuni neoplazice limitată la epiteliul glandular endocervical fără a depăşi membrana bazală
– este indicaţie de excizie, conizaţie sau histerectomie în funcţie de caz
Adenocarcinomul endocervical, endometrial sau extrauterin (ovarian, salpingian): este o leziune care a depăşit epiteliul de suprafaţă şi are capacitate invazivă.
- Alte neoplasme: în această categorie sunt incluse tumorile primare rare ale colului uterin (carcinomul cu celule mici, carcinosarcomul, tumori germinative, limfoame etc.), precum şi cele secundare (endometru, rect, vezică urinară) sau de origine metastatică (sân, melanom etc.).
Fig.22.7: Recomandări ASC-US9
Fig 22.8: Recomandări ASC-H9
Fig.22.9: Recomandări LSIL9
Fig.22.10: Recomandări HSIL9
Fig.22.11: Recomandări în AGC9
Fig.22.12: Recomandări AIS9
Bibliografie
1. Alexander Meisels, Carol Morin. Modern Uterine Cytopathology. Moving to the Molecular Smear. ASCP Press, Chicago, IL, 2007, 155-162; 369-375.
2. Wright TC, Massad LS, Dunton CJ, Spitzer M, Wilkinson EJ, Solomon D. 2006 consensus guidelines for the management of women with abnormal cervical cancer screening tests. In Journal of Low Genital Tract Disease, 2007.
3. Diane Solomon, Ritu Nayar. Sistemul Bethesda de raportare a citologiei colului uterin, Ed. Medicală Calisto, 2009.
4. H.F.Nauth, Gynecological Cytology, Georg ThiemeVerlag, 2007, 335-338.
5. Laborator Synevo. Referintele specifice tehnologiei de lucru utilizate. Ref type: Internet Communication.
6. M. Arbyn, A. Anttila, J. Jordan, G. Ronco, U. Schenck, N. Segnan, H. Wiener, A. Herbert & L. von Karsa. European Guidelines for Quality Assurance in Cervical Cancer Screening. Second Edition—Summary Document, In Annals of Oncology 21, 2010: 448–458
7. M. Arbyn, A. Herbert, U. Schenck, P. Nieminen, J. Jordan, E. Mcgoogan, J. Patnick, C. Bergeron, J-J. Baldauf, P. Klinkhamer, J. Bulten and P. Martin-Hirsch. European guidelines for quality assurance in cervical cancer screening: recommendations for collecting samples for conventional and liquid-based cytology. In Cytopathology 2007, 18, 133– 139.
8. Marluce Bibbo, David C. Wilbur, Comprehensive Cytopathology, Third Edition, Saunders Elsevier 2008.
9. Richard Mac DeMay, The Pap Test, ASCP Press, Chicago, 2005;
10. www.bd.com .
Abrevieri:
AGC – celule glandulare atipice
AIS – adenocarcinom in situ
ASC – celule scuamoase atipice
ASC-US – celule scuamoase atipice cu semnificaţie nedeterminată
ASC-H – celule scuamoase atipice fără a se putea exclude o leziune de grad înalt
ASCCP – American Society of Colposcopy and Cervical Pathology
CIN – neoplazie cervicală intraepitelială
CIS – carcinom in situ
HPV – virusul papilloma uman
HSIL – leziune scuamoasă intraepitelială de grad înalt
LBC – Liquid Base Cytology – citologie în mediu lichid
LSIL – leziune scuamoasă intraepitelială de grad scăzut
NILM – negativ pentru leziuni maligne intraepiteliale
NOS – (no other specifications) fără alte specificaţii
SCC – carcinomul scuamocelular
TBS – The Bethesda System